Madame P. est une femme de 34 ans lors de la première prise en charge, où lui est diagnostiqué un cancer du sein gauche de 6 cm. La microbiopsie pose le diagnostic histologique de carcinome canalaire invasif, exprimant à la fois le récepteur à l’estradiol (RE+) et à la progestérone (RP+), surexprimant HER2, avec un index de prolifération Ki67 à 30%. Elle n’a pas d’antécédent familial de cancer, et est porteuse d’un syndrome d’Ehlers-Danlos. Malgré son jeune âge, aucune mutation germinale n’est alors identifiée dans un panel de gènes prédisposant au cancer du sein. Dans ce contexte de cancer localement évolué, elle reçoit une chimiothérapie néoadjuvante à base d’anti-HER2, suivie d’une mastectomie totale et d’une radiothérapie de la paroi thoracique. Le trastuzumab est ensuite maintenu pendant un an, et elle reçoit une hormonothérapie pendant une durée totale de cinq ans.
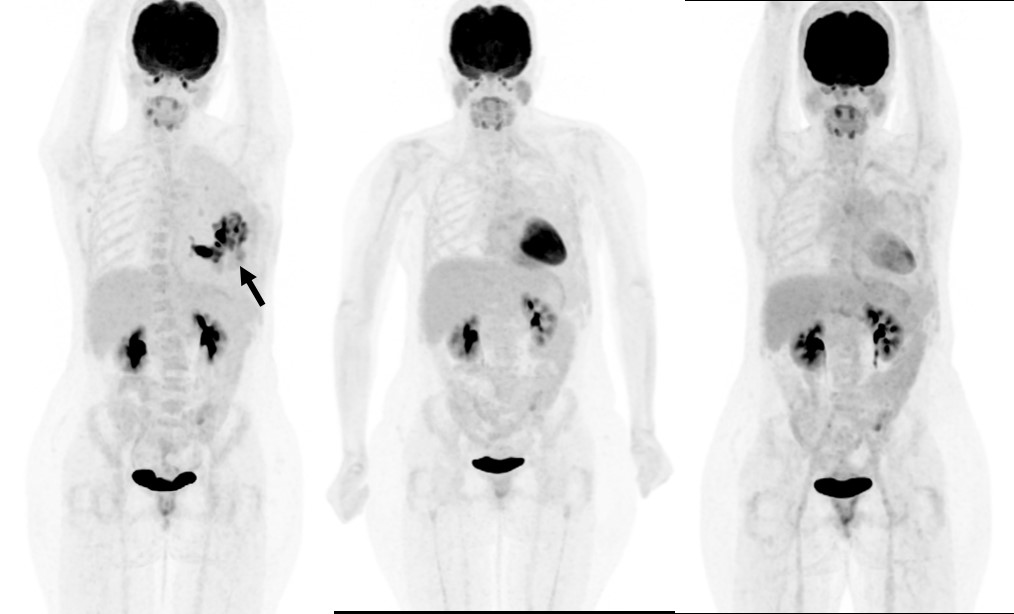
Six ans après cette prise en charge du cancer du sein et à la fin de la radiothérapie, elle rapporte des douleurs intenses et continues de la paroi thoracique gauche, d’aggravation progressive. L’examen clinique est peu contributif sur une paroi très indurée, post-radique et dans le contexte du syndrome d’Ehlers-Danlos. Une imagerie par TEP met en évidence une masse hypermétabolique de 10 cm (panel de gauche). Une biopsie de la masse pose alors le diagnostic d’ostéosarcome de haut grade. La patiente reçoit, dès le diagnostic, une combinaison de chimiothérapie par doxorubicine, ifosfamide et cisplatine, permettant une sédation très rapide des douleurs et une excellente réponse partielle métabolique après 5 cycles (panel du milieu).
Parallèlement à cette chimiothérapie, un séquençage de l’ADN constitutionnel et de l’ADN tumoral sont effectués par le laboratoire SeqOIA. En raison de la mauvaise qualité des acides nucléiques, l’analyse RNAseq ne peut être effectuée. Le séquençage tumoral retrouve une faible charge mutationnelle avec 2 mutations/mégabase, associée à une signature mutationnelle SBS3 de déficit de recombinaison homologue (HRD), et plusieurs événements spécifiques d’un déficit HRD. En particulier, une mutation du gène FANCM est identifiée, également présente au niveau germinal à l’état hétérozygote (anomalie confirmée ensuite par séquençage Sanger). L’analyse somatique montre également une perte d’hétérozygotie (LOH) au niveau du locus de FANCM. Ce variant de FANCM correspond à une modification de la protéine au niveau d’un domaine fonctionnel très conservé, en faveur de sa pathogénicité.
Chez Madame P., l’association de la signature SBS3 avec un score HRD élevé combiné à une inactivation bi-allélique de FANCM conduit donc à lui proposer un traitement d’entretien par inhibiteur de PARP après la très bonne réponse à la chimiothérapie. Elle débute alors un traitement par olaparib, à une dose de 300 mg deux fois par jour. Après 3 mois de traitement, elle est en réponse métabolique complète (panel de droite). A plus de 15 mois de traitement par olaparib, la réponse complète est maintenue.
Pour cette jeune femme avec une génétique défavorable responsable d’une cancérogenèse multiple, en situation de recours, cette situation exemplaire d’une signature génomique simple met en évidence les avantages de la médecine de précision utilisant un laboratoire de séquençage moderne et des médicaments ciblés innovants personnalisés. En effet, sans ce résultat de séquençage, l’identification des différentes anomalies ayant conduit au traitement par olaparib et qui a permis d’obtenir une réponse complète maintenue plus de 15 mois, n’aurait pas été possible. La chimiothérapie n’aurait pas pu être poursuivie beaucoup plus longtemps (toxicités cumulatives), et la maladie aurait rapidement ré-évolué.

