Le Dr Benjamin Verret, oncologue à Gustave Roussy et spécialiste des sarcomes et du cancer du sein, présente à l’ESMO 2024 les premiers résultats de l’étude MULTISARC, qui ouvre la voie à une stratégie innovante de prise en charge des sarcomes des tissus mous localement avancés ou métastatiques. Basée sur l’analyse moléculaire de la tumeur et sur un traitement adapté à cette analyse, cette stratégie utilisée lors d’un premier essai clinique a permis d’obtenir des résultats très encourageants. Il existe actuellement une dizaine de thérapies ciblées disponibles pour ces patients. »
Les sarcomes des tissus mous (STM) représentent 1% des cancers de l’adulte et 15% des cancers de l’enfant. Malgré un traitement locorégional bien conduit, 40% des patients vont développer une rechute métastatique. Les options de traitement sont alors limitées et la médiane de survie chez ces patients reste faible (entre 12 et 18 mois), sans amélioration depuis les années 1970. Des travaux récents ont mis en évidence que la réalisation d’un séquençage génétique pouvait permettre de mettre en évidence une altération génomique actionnable chez près de 50% des patients atteints de STM.
L’essai MULTISARC, est un essai clinique multicentrique randomisé de médecine génomique personnalisée incluant des patients atteints de STM métastatiques. Le schéma de l’étude inclut un séquençage de l’exome et du transcriptome, afin de pouvoir proposer un accès à des molécules ciblées à chaque patient présentant une altération ou une signature d’expression actionnable.
L’essai MULTISARC a pour objectif principal d’évaluer la faisabilité du séquençage de l’exome et du transcriptome chez des patients atteints de STM avancés. La faisabilité est définie comme étant la proportion de participants pour lesquels les résultats de séquençage sont interprétables, discutés en RCP (réunion de concertation multidisciplinaire) et transmis à l’investigateur dans un délai de 7 semaines suivant la réception des échantillons.
Cet essai permettra également de déterminer si le choix des traitements guidé par le séquençage génomique est une stratégie qui améliore la survie des patients. Ainsi, grâce à un partenariat public-privé avec 4 industriels, 10 thérapies ciblées sont disponibles en monothérapie ou en combinaison dans le cadre de sous-essais de phase II, dont l’objectif est d’évaluer l’efficacité de la thérapie ciblée en terme de taux de non-progression à 6 mois. Les patients inclus dans le bras avec séquençage et pour lesquels il aura été mis en évidence une altération génomique ciblable par l’une des thérapies ciblées disponibles pourront en bénéficier. Les participants ayant été randomisés dans le bras sans séquençage pourront être inclus dans le bras avec séquençage après échec des traitements standards.
Les 10 traitements disponibles sont : TAS-120, Olaparib-Durvalumab, Nilotinib, Lapatinib, Céritinib, Capmatinib, Trametinib, Trametinib-Dabrafenib, Palbociclib et Glasdegib.
OÙ EN EST-ON ?

Le communiqué de presse de Gustave Roussy
« Des traitements personnalisés contre les sarcomes des tissus mous :

Les patients qui étaient incluables dans cet essai peuvent être adressés désormais au PFMG2025 au travers du réseau Sarcomes de la préindication Cancers Rares.




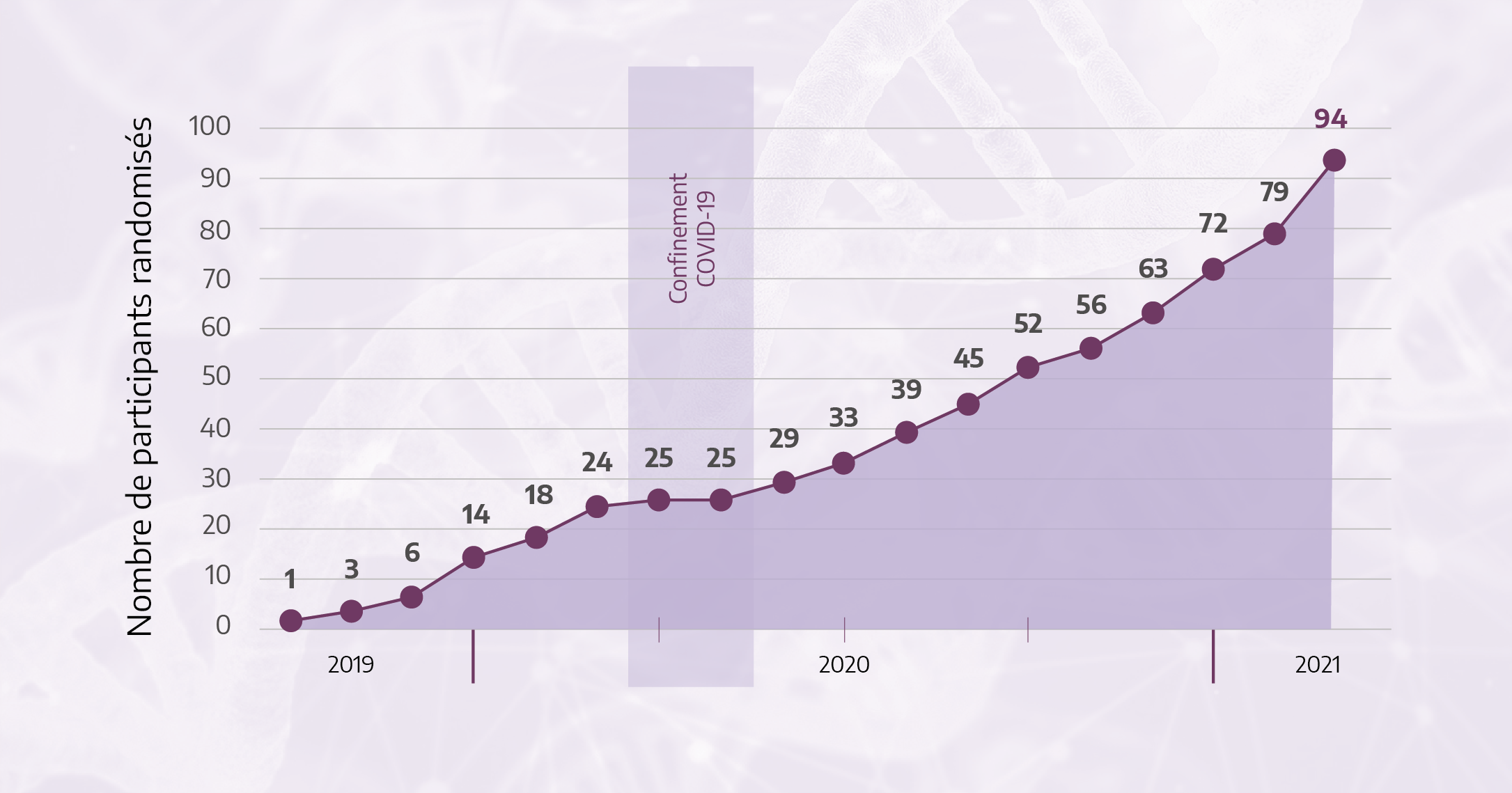
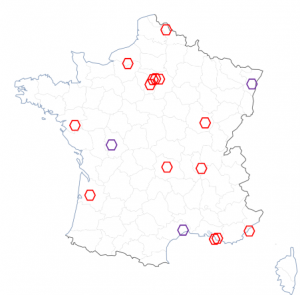
Grâce aux efforts de toutes les équipes impliquées depuis la mise en œuvre de l’étude en octobre 2019, 94 patients ont été randomisés dans les 14 centres ouverts aux inclusions, dont 47 patients sont randomisés dans le bras « avec séquençage ». Les échantillons de 43 patients ont été analysés. Parmi eux, 23 ont au moins une altération ciblable dans le cadre de l’essai, au sein desquels 6 d’entre eux ont terminé leur première ligne de traitement et ont donc ainsi pu être inclus par la suite dans un des sous-essais de phase II.
Ci-après la courbe des inclusions et la répartition des centres ouverts (en rouge) ou des ouvertures prévues (en violet) montrant la couverture territoriale.



Les autorisations réglementaires de l’Agence nationale de sécurité du médicament (ANSM) et de la Commission nationale de l’informatique et des libertés (CNIL) et l’avis favorable du Comité de protection des personnes (CPP) sont obtenus.


Le partenariat public -privé a abouti à la suite d’une sélection de laboratoires pharmaceutiques.

